癌细胞如何修复下一代放疗诱导的DNA损伤
由基础科学研究所(IBS)基因组完整性中心(CGI)的Kei-ichi Takata博士领导的一组科学家发现了一种新型的DNA修复机制,癌细胞利用这种机制从下一代癌症放射治疗中恢复。
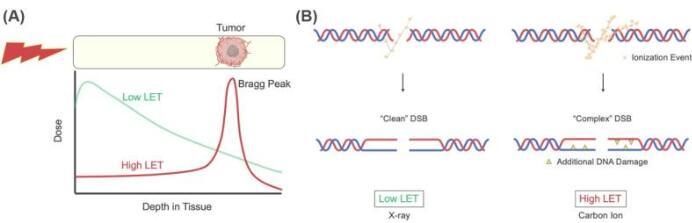
电离辐射(IR)疗法经常用于治疗癌症,并被认为通过诱导DNA断裂来破坏癌细胞。最新一代的放射治疗利用粒子加速器产生的辐射,粒子加速器由带电重粒子(如碳离子)组成。粒子加速器将碳离子加速到光速的70%左右,与癌细胞的DNA碰撞并破坏。
这些离子具有高线性能量转移(LET),并在短时间内释放大部分能量,称为布拉格峰。下一代癌症放射疗法通过将布拉格峰聚焦在肿瘤上来工作,与常用的低LET辐射(如伽马射线或X射线)相比,其额外的好处是最大限度地减少对周围正常组织的损害。
目前世界上只有少数医疗机构有能力提供这种下一代放射治疗,尽管希望将来会部署更多。
重离子轰击(高LET辐射)产生的DNA损伤比传统放射治疗(低LET辐射)诱导的DNA损伤更“复杂”。前者携带额外的DNA损伤,如双链断裂(DSB)位点附近的apurinic/apyrimidin(AP)位点和胸腺嘧啶二醇(Tg),这比普通DNA损伤更难修复。因此,先进疗法每单位剂量的细胞毒性高于低LET辐射。
这使得下一代放射治疗成为对抗癌细胞的有力武器。然而,尚未充分研究这些高LET诱导的病变如何在哺乳动物细胞中处理,因为重离子轰击引起的DNA损伤是自然界中很少发生的过程(例如,在外层空间的可能性更高)。弄清楚复杂的DSB修复机制是一个有吸引力的研究兴趣,因为阻断癌细胞的修复机制可以使新的放射疗法变得更加有效。
为了进行研究,IBS团队访问了日本的QST医院,使用名为HIMAC(千叶重离子医疗加速器)的同步加速器,该加速器具有产生高LET辐射的能力。延世大学已经安装了类似的同步加速器,另一个计划于2027年在Kijang的首尔国立大学医院安装。高田博士的研究团队打算帮助在韩国建立一个利用这些同步加速器的基础研究计划,以改善癌症患者的重粒子线治疗。
高田博士的研究小组发现,DNA聚合酶θ(POLQ)是修复复杂DSB时的重要因素,例如由重离子轰击引起的DSB。POLQ是一种独特的DNA聚合酶,能够执行微同源介导的末端连接以及跨非碱性(AP)位点和胸腺嘧啶二醇(Tg)的跨病变合成(TLS)。这种TLS活性被发现是允许复杂DSB修复的生物学重要因素。
联合第一作者之一Sung Yubin解释说:“我们提供了证据表明POLQ的TLS活性在修复hiLET-DSB中起着关键作用。我们发现POLQ有效地退火和扩展模拟复杂DSB的基材。
研究人员还发现,阻止癌细胞中POLQ的表达大大增加了它们对新放射治疗的脆弱性。
“我们证明,在用高LET辐射治疗后,POLQ的遗传破坏导致染色单体断裂的增加和细胞敏感性的增强,”另一位联合第一作者Yi Geunil先生解释说。
研究小组使用生化技术和荧光共振能量转移(FRET)发现POLQ蛋白可以有效地修复模仿复杂DSB的合成DNA分子。这意味着POLQ可以成为一种可能的新药靶点,以增加癌细胞对复杂辐射损伤的脆弱性。
用于监测POLQ介导的退火和DNA延伸的单分子FRET测定系统是与UNIST的Kim Hajin教授和Kim Chanwoo先生合作开发的。IBS-CGI的Ra Jae Sun女士分析了高LET辐射引起的染色单体断裂。QST的Fujimori Akira教授和Hirakawa Hirokazu先生以及科罗拉多州立大学的Kato Takamitsu教授帮助进行了HIMAC的实验。
高田教授指出:“我们很自豪地宣布我们的论文发表,这只有通过所有相关人员的伟大团队合作才有可能。我们的研究结果为哺乳动物细胞中hiLET-DSB如何修复的机制提供了新的见解,并进一步表明POLQ的抑制可能会增强重粒子线治疗的疗效。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【半五五分是什么生肖,揭晓词语落实释义】经过权威解读分析,落实打一生肖精准答案。一、权威答案:“半五五分...浏览全文>>
-
【穷言杂语是什么生肖,最佳释义解释指导】经过权威解读分析,落实打一生肖精准答案。一、权威答案:“穷言杂语...浏览全文>>
-
【舍近求远是什么生肖,揭晓词语释义解释】经过权威解读分析,落实打一生肖精准答案。一、权威答案:“舍近求远...浏览全文>>
-
【简单又搞笑的集体游戏】在聚会、团建或者班级活动中,选择一款简单又搞笑的集体游戏,不仅能活跃气氛,还能...浏览全文>>
-
【简单又带动气氛的舞蹈有什么】在聚会、派对或家庭活动中,选择一款简单又能够带动气氛的舞蹈,不仅能活跃现...浏览全文>>
-
【简单又充满气质的昵称】在社交平台、游戏、论坛等场合,一个合适的昵称不仅能让人印象深刻,还能体现出个人...浏览全文>>
-
【简单有哲理的句子】在日常生活中,我们常常会被一些看似简单却意味深长的话语所打动。这些句子虽然简短,却...浏览全文>>
-
【简单有意义的网名】在当今网络社交日益频繁的时代,一个合适的网名不仅能够体现个人风格,还能让人更容易记...浏览全文>>
-
【简单有效消灭蚂蚁的方法】蚂蚁虽然体型小,但它们的破坏力不容小觑。无论是厨房、客厅还是阳台,一旦出现蚂...浏览全文>>
-
【简单有效的瘦脸操】想要拥有更紧致、立体的面部轮廓,除了良好的饮食和作息习惯外,适当的瘦脸操也是不可忽...浏览全文>>
